- トップページ
- 大学院紹介
- 医療技術科学専攻のご紹介
- 医療技術科学専攻 分子細胞生物学 教授 松村美紀
更新日:2020年1月16日
医療技術科学専攻のご紹介
医療技術科学専攻 分子細胞生物学 教授 松村美紀
 プロフィール
プロフィール担当科目
医療技術科学研究方法論(専門共通)、分子細胞生物学特論、遺分子細胞生物学演習、特別研究(専門科目)
研究紹介
真核生物である私たちの体は約37兆個の細胞からできており、個々の細胞の中には生体膜で囲まれた核やミトコンドリア、ゴルジ体などの細胞内小器官が存在します。そして細胞の様々な場所で、多様な生化学反応が起こっています。細胞小器官の一つである『細胞核』は核膜内膜、核膜外膜と呼ばれる2枚の生体膜で囲まれており、遺伝情報であるゲノムの保持と複製、遺伝情報発現の出発点である転写が行われています。そして細胞は細胞内外の情報を核へ集約し、転写制御を行い、個体の恒常性を維持しています。核と細胞質を隔てる核膜には100種類以上の多様なタンパク質が存在することが明らかになっています。その中にLINC複合体と呼ばれるタンパク質複合体が存在しており、LINC複合体の構成因子や、複合体と相互作用する因子をコードする遺伝子に変異がはいると、エメリー・ドレイフィス型筋ジストロフィー (EDMD) や、ハッチンソン・ギルフォード早老症 (HGPS)、リポジストロフィ、先天性拡張型心筋症、家族性自閉症など、一連の遺伝性疾患を引き起こすことが明らかにされています。これらの疾患は核膜タンパク質とその相互作用タンパク質をコードする遺伝子の変異により発症するため、核膜病と呼ばれています。これら疾患の発症メカニズムはいずれもよくわかっておらず、治療法も確立されていません。私たちは、核膜の構造と機能を理解することを目的として、次の2点を軸に研究をすすめています。そしてこれらの研究から、核膜タンパク質の核膜病へ関与を分子レベルで明らかにし、治療法の確立、創薬の開発への道筋を探りたいと考えています。
1.LINC複合体による細胞内小器官の構築制御メカニズムの解明
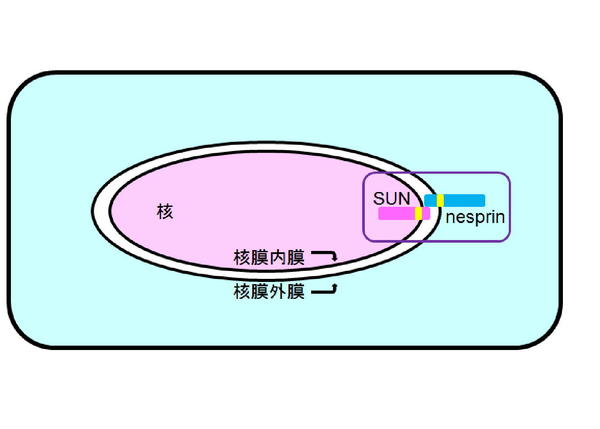
2.LINC複合体によるメカノシグナリングメカニズムの解明
最近の業績
原著論文 (2016~)
- Nishino, M., Imaizumi, H., Yokoyama, Y., Katahira, J., Kimura, H., Matsuura, N., Matsumura, M. (2023) Histone methyltransferase SUV39H1 regulates the Golgi complex via the nuclear envelope-spanning LINC complex. PLoS One. 8:e0283490. doi: 10.1371/journal.pone.0283490.
- Katahira, J., Ohmae, T., Yasugi, M., Sasaki, R., Itoh, Y., Kohda, T., Hieda, M., Yokota, Hirai, M., Okamoto, T., Miyamoto, Y. Nsp14 of SARS-CoV-2 inhibits mRNA processing and nuclear export by targeting the nuclear cap-binding complex. Nucleic Acids Research. In press doi: 10.1093/nar/gkad483.
- Imaizumi, H., Minami, K., Hieda, M., Narihiro, N., Koizumi, M. (2023) The linker of nucleoskeleton and cytoskeleton complex is required for X-ray-induced epithelial-mesenchymal transition. J Radiation Research. 64:358-368. doi: 10.1093/jrr/rrac104.
- Ueda, N., Maekawa, M., Matsui, T. S., Deguchi, S., Katahira, J., Higashiyama, S., Hieda, M. (2022). Inner nuclear membrane protein, SUN1, is required for cytoskeletal force generation and focal adhesion maturation. Frontiers Cell and Developmental Biology, 10, 885859. doi: 10.3389/fcell.2022.885859.
- Hieda, M., Matsumoto, T., Isobe, M., Kurono, S., Yuka, K., Kametaka, S., Wang, J.Y., Chi, Y.H., Kameda, K., Kimura, H., Matsuura, N., Matsuura, S. (2021) The SUN2-nesprin-2 LINC complex and KIF20A function in the Golgi dispersal. Scientific Report, 11, 5358. doi: 10.1038/s41598-021-84750-4.
- Satomi, E., Ueda, M., Katahira, J., Hieda, M. (2020) The SUN1 splicing variants SUN1_888 and SUN1_916 differentially regulate nucleolar structure. Genes to Cells, 11, 730-740. doi: 10.1111/gtc.12807.
- Katahira, J., Senokuchi, K., Hieda, M. (2020) Human THO maintains the stability of repetitive DNA, Genes to Cells, 25, 334-342. doi: 10.1111/gtc.12760.
- Watanabe, R., Maekawa, M., Hieda, M., Taguchi, T., Miura, N., Kikugawa, T., Saika, T., Higashiyama, S. (2020) SPOP is essential for DNA-protein crosslink repair in prostate cancer cells: SPOP-dependent removal of topoisomerase 2A from the topoisomerase 2A-DNA cleavage complex. Molecular Biology of the Cell, 31, 478-490. doi: 10.1091/mbc.E19-08-0456.
- Katahira, J., Ishikawa, H., Tsujimura, K., Kurono, S., Hieda, M. (2019) Human THO coordinates transcription termination and subsequent transcript release from the HSP70 locus. Genes to Cells, 24, 272-283. doi: 10.1111/gtc.12672.
- Imaizumi, H., Sato, S., Nishihara, A., Minami, K., Koizumi, M., Matsuura, N., and Hieda, M.(2018) X-ray-enhanced cancer cell migration requires the linker of nucleoskeleton and cytoskeleton complex. Cancer Science, 109, 1158-1165. doi: 10.1111/cas.13545.
- Nishioka, Y., Imaizumi, H., Imada, J., Katahira, J., Matsuura, N., Hieda, M. (2016) SUN1 splice variants, SUN1_888, SUN1_785, and predominant SUN1_916, variably function in directional cell migration. Nucleus, 7, 572-584. doi: 10.1080/19491034.2016.1260802.
総説
- Hieda, M. (2019) Signal transduction across the nuclear envelope: role of the LINC Complex in bidirectional signaling. Cells, 8, pii: E124. doi: 10.3390/cells8020124. (Invited review).
- Matsumoto, A., Matsuura, N., Hieda, M. (2018) Detection of SUN1 splicing variants at the mRNA and protein levels in cancer. Methods in Molecular Biology, 1840:307-319. doi: 10.1007/978-1-4939-8691-0_21. (Invited review).
- Hieda, M. (2017) Implications for diverse functions of the LINC complexes based on the structure. Cells, 6, pii: E3. doi: 10.3390/cells6010003. (Invited review).
著書
- Matsumura, M., Oka, M., Yoneda, Y. Molecular Architecture of the Nuclear Pore Complex. Elsevier, The Encyclopedia of Cell Biology, 2nd edition (edited by Ralph Bradshaw and Phil Stahl), Organelles: Structure and Function| Nuclear Pore. in press.
- Takata, T., Hieda, M. The LINC complex assists the nuclear import of mechanosensitive transcriptional regulators. Springer, Springer Nature series, Results and Problems in Cell Differentiation, the volume on the "Nuclear, chromosomal and genomic architecture in biology and medicine" (edited by Malgorzata Kloc and Jacek Z. Kubiak) 2022, 70:315-337. doi: 10.1007/978-3-031-06573-6_11.
- 檜枝美紀, 核におけるメカノシグナリング. 羊土社実験医学増刊号クリニカルクエスチョンに挑むメカノバイオロジー (曽我部正博編) 2020, 178-184 (1238-1244).
詳細な業績はこちらに→ orcid.ID https://orcid.org/0000-0002-9492-7506
お知らせ(受験生へのコメント)
一緒に研究を楽しめる学生を募集しています。
- トップページ
- 大学院紹介
- 医療技術科学専攻のご紹介
- 医療技術科学専攻 分子細胞生物学 教授 松村美紀
このページに関するお問い合わせ
- 保健医療学研究科
-
電話番号:089-958-2111 ファックス番号:089-958-2177





